Tomio Okamura
Předseda SPD, poslanec
Odborníci (...) (Jan Pirk, Soňa Peková, Jiří Beran a další, pozn. Demagog.cz) říkají, že ‚vakcíny jsou experimentální, nemají dosud ukončené třetí fáze klinických studií (...)‘.
Danou citaci obsahuje petiční výzva uvedených odborníků. Vakcíny, které jsou nyní podmínečně registrovány v zemích EU, tedy i v ČR, však již prošly všemi třemi základními fázemi klinického hodnocení. Splňují normy pro bezpečnost, účinnost a kvalitu, a nejsou tedy experimentální.
Tomio Okamura ve výroku cituje petiční výzvu, kterou podepsali někteří lékaři a odborníci, mezi nimiž jsou například prof. Jiří Beran, MUDr. Soňa Peková a prof. Jan Pirk. V textu petice její signatáři skutečně uvádějí, že „vakcíny jsou experimentální, nemají dosud ukončené třetí fáze klinických studií, (…)“. Toto tvrzení nicméně není pravdivé, a výrok Tomia Okamury tak hodnotíme jako zavádějící.
V České republice a v Evropské unii jsou nyní k používání schváleny 4 očkovací látky proti nemoci covid-19. Jsou jimi:
- Vaxzevria (AstraZeneca) – dvoudávková adenovirová vakcína,
- Janssen (Johnson & Johnson) – jednodávková adenovirová vakcína,
- Comirnaty (Pfizer/BioNTech) – dvoudávková mRNA vakcína,
- Spikevax (Moderna) – dvoudávková mRNA vakcína.
Nejen vakcíny, ale i léky prochází přísným testováním v laboratoři a následně klinickým hodnocením, které se skládá ze tří základních fází (.pdf, str. 2–4). V první fázi se na menším počtu dobrovolníků vyhodnocuje například bezpečnost vakcíny a její tolerance lidským organismem. Ve druhé fázi se poté na několika stovkách osob zkoumá, „jakou velikost dávky je nejlépe použít, jaké jsou nejčastější vedlejší účinky a kolik dávek je zapotřebí“ (.pdf, str. 3). Ve třetí fázi následně probíhá tzv. studie účinnosti a bezpečnosti, která zahrnuje tisíce dobrovolníků (.pdf, str. 3) a jejímž účelem je kromě jiného zjistit méně časté vedlejší účinky a míru ochrany před příslušnou infekcí.
Přestože je vývoj vakcín proti onemocnění covid-19 urychlen, je zachováno veškeré testování a očkovací látky jsou dostupné až po ukončení třetí fáze a vědeckém vyhodnocení a registraci (.pdf, str. 4).
V Evropské unii schvaluje nejen očkovací látky, ale obecně léčivé přípravky Evropská léková agentura (EMA). Výše uvedené čtyři vakcíny proti nemoci covid-19 jsou podmínečně schváleny pro použití v zemích EU, nicméně to neznamená, že by byly „experimentální“. Podmínečné schválení/registrace umožňuje, aby byly léčivé přípravky co nejdříve uvedeny na evropský trh v případě mimořádných událostí (jakou je i pandemie covidu-19) a pomohly zachránit co nejvíce životů. I přesto, že se jedná o časově kratší proceduru, podmínečné schválení stále zaručuje, že vakcíny splňují přísné normy EU pro bezpečnost, účinnost a kvalitu.
Rozdíl mezi podmínečnou registrací a standardní registrací je pak také v tom, kdy probíhá čtvrtá, tzv. poregistrační fáze klinické studie, v jejímž rámci se dále sleduje účinnost a bezpečnost vakcíny (.pdf, str. 3). Tato čtvrtá fáze začíná v případě podmínečné registrace dříve a léčivý přípravek je pro pacienty dostupný ještě před jejím dokončením (.pdf, str. 2–4). Upřesněme, že v průběhu poregistrační fáze musí výrobci vakcín Evropské lékové agentuře poskytovat informace z probíhajících studií, aby se potvrdilo, že přínosy dané vakcíny převažují rizika.
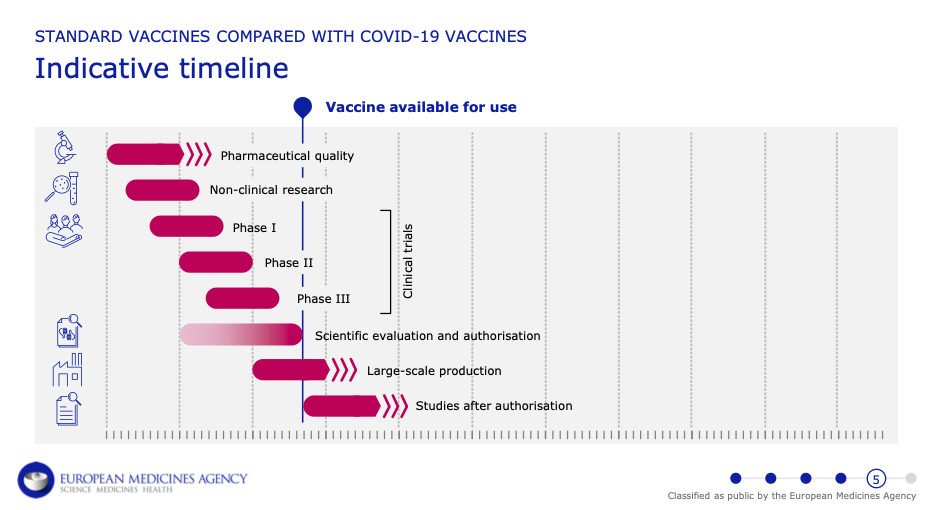
Zmiňme, že v případě vakcín AstraZeneca, Johnson & Johnson, Pfizer/BioNTech i Moderna již byly 3. fáze dokončeny, 4. fáze pak stále probíhají.
Pro úplnost doplňme, že vývoj vakcín proti covidu-19 probíhal poměrně rychle díky skutečnosti, že výzkumníci mohli vycházet z dlouholetých zkušeností s vývojem vakcín proti onemocněním, která způsobují podobné typy koronavirů. Časopis Nature nebo web Medici pro očkování v této souvislosti upozorňují především na předchozí vývoj vakcín proti virům „podtypu SARS, který vyvolal epidemii v roce 2002, a MERS, zodpovědný za stovky obětí v oblasti blízkého východu v roce 2012.“